Étude OptiMA au Burkina Faso : résultats initiaux et nouvelles perspectives
Par Kevin PQ Phelan
Kevin PQ Phelan est conseiller en nutrition chez ALIMA, Alliance for International Medical Action basée à Paris. Avant de rejoindre ALIMA, il a travaillé pendant plus de dix ans pour Médecins Sans Frontières (MSF), dans différents postes, allant de la communication de crise à la direction du groupe de travail sur la nutrition.
L'étude OptiMA-Burkina Faso a été financée par la Direction générale de la protection civile et des opérations d’aide humanitaire européennes (ECHO), l'Agence américaine pour le développement international (USAID) et la Fondation Médecins Sans Frontières.
Lieu : Burkina Faso
Ce que nous savons : Différents protocoles, produits nutritionnels et mécanismes de coordination sont généralement utilisés pour le traitement de la malnutrition aiguë sévère (MAS) et de la malnutrition aiguë modérée (MAM), ce qui limite la continuité pour les soins d’une pathologie continue.
Qu'apporte cet article : le traitement Optimisé d'ALIMA contre la MAlnutrition aiguë (OptiMA) est une approche simplifiée de la prise en charge actuelle des cas de malnutrition aiguë basée sur des preuves existantes et émergentes. Il est centré sur la mesure du PB famille (dépistage à domicile par la mère/le responsable de l’enfant), un critère d’admission unique (PB <125 mm et/ou œdèmes), un traitement unique (ATPE, aliment thérapeutique prêt à l’emploi) et la rationalisation des doses d’ATPE selon le degré d'émaciation. Une étude pilote (2016-2018) a testé ce nouveau protocole en comparaison à un contrôle (soins standard) dans 54 centres de santé d'un district du Burkina Faso ; 5 000 enfants y ont pris part. La prévalence simultanée du retard de croissance était élevée (42%) et était associée au degré d'émaciation. Les résultats complets seront publiés bientôt. Des recherches supplémentaires sont prévues en République démocratique du Congo, au Niger et au Mali. Un plus grand nombre d’essais contrôlés randomisés est nécessaire pour tester l’efficacité des réductions de dose d’ATPE, la "sécurité" liée à l’exclusion des enfants avec un PB >125 mm mais un P/T <-2 et les seuils de PB spécifiques en fonction du sexe du patient. Des études d'observation sont également nécessaires dans plusieurs contextes, en utilisant des données de programme de haute qualité.
Contexte
La pratique courante actuelle, en matière de prise en charge communautaire de la malnutrition aiguë (PCMA), est guidée par la déclaration commune des Nations Unies de 2008 et les protocoles génériques ultérieurs qui, en théorie, intègrent les soins de la malnutrition aiguë sévère (MAS) et de la malnutrition aiguë modérée (MAM). Cependant, les limites de l'approche actuelle sont évidentes depuis des années : les services MAS et MAM utilisent des protocoles et des produits différents, et des agences des Nations Unies distinctes soutiennent les efforts déployés au niveau des pays pour une même pathologie continue. Souvent, les traitements ne sont disponibles que pour les enfants en situation de MAS, ce qui entraîne des vies perdues et une hospitalisation coûteuse qui pourraient être évitées si un soutien nutritionnel était disponible plus tôt dans le processus d'émaciation. L'augmentation du nombre d'enfants traités pour les deux affections s'est stabilisée depuis 2015.
Les participants à un atelier des agences des Nations Unies à Dakar en 2017 (ACF et al, 2017) ont identifié plusieurs obstacles empêchant de traiter davantage d'enfants, notamment des coûts et une charge de travail élevés, une gouvernance médiocre, une capacité en ressources humaines réduite, des systèmes d'information parallèles avec des données de mauvaise qualité et des chaînes d'approvisionnement complexes entraînant des ruptures de stock. De plus, les programmes MAS et MAM sont chroniquement sous-financés. Selon un rapport publié en 2016 par la Banque mondiale, 900 millions de dollars supplémentaires par an au niveau mondial seraient nécessaires pour réduire l'émaciation à l'échelle requise (Shekar et al, 2017). Les coûts principaux de la PCMA comprennent le temps passé par le personnel de santé, les aliments thérapeutiques prêts à l’emploi (ATPE) pour la MAS, et les aliments supplémentaires prêts à l’emploi (ASPE) pour la MAM. Ainsi, les programmes qui utilisent efficacement le temps des agents de santé et appliquent un ciblage intelligent d’un produit (ATPE) dans un protocole unique peuvent permettre de surmonter bon nombre des obstacles identifiés.
En raison des difficultés inhérentes à l’approche actuelle de la MAM/MAS, de nombreuses organisations se sont penchées sur des protocoles alternatifs simplifiés. Le traitement Optimisé d'ALIMA contre la MAlnutrition aiguë (OptiMA) est l'une de ces stratégies, proposant trois modifications principales aux protocoles actuels :
1. Une détection plus précoce, grâce à la formation des mères et des responsables des enfants à l’utilisation de la mesure du périmètre brachial (PB) pour dépister régulièrement les enfants atteints de malnutrition à la maison (par exemple, le « PB famille »).
2. Une simplification de la prise en charge en utilisant une seule mesure anthropométrique (PB <125 mm et/ou œdèmes) pour les admissions et un produit unique (ATPE) pour le traitement.
3. Une utilisation plus intelligente de l’intrant le plus coûteux (ATPE) en réduisant progressivement la posologie en fonction du PB et du poids de l’enfant afin d’augmenter le nombre d’enfants ayant accès au traitement sans aucun coût additionnel.
Justification
Il existe de plus en plus de preuves pour chacun de ces trois éléments. ALIMA a été la première organisation à montrer que les mères pouvaient dépister la malnutrition après avoir été formées à l'utilisation de bracelets pour mesurer le PB sur leurs propres enfants (Blackwell et al, 2015), et que cela pouvait favoriser une détection précoce et réduire les coûts globaux en hospitalisations lors de la mise à l'échelle (Alé et al, 2016). Des résultats encourageants ont été constatés avec des programmes qui n'utilisent que les critères de PB pour les admissions, la prise en charge et la décharge du traitement (tels que Binns et al, 2016). En outre, dans différents contextes, il a été démontré que l'augmentation du PB était parallèle au gain de poids ; les deux sont très rapides au cours des premières semaines de traitement de la MAS, avant de se stabiliser (Goossens et al, 2015). Cette tendance est similaire chez les enfants en situation de MAM (Fabiansen et al, 2015). Au Myanmar, un schéma posologique réduit pour les ATPE a donné des résultats qui dépassaient les standards Sphere (Philip et al, 2015).
Sous OptiMA, le diagnostic de malnutrition aiguë est affiné pour cibler le traitement des enfants présentant un PB <125 mm ou des œdèmes. La simplicité de la mesure du PB permet aux familles de dépister les enfants, de vérifier la présence d'œdèmes à la maison et d’identifier de manière continue les enfants souffrant de malnutrition (Alé et al, 2016). Le diagnostic est rapidement confirmé par les cliniciens du centre de santé. La progression du PB est également utilisée pour surveiller la guérison et déterminer le moment de l'arrêt des soins, éliminant ainsi les divergences qui se produisent lorsque le PB et le P/T sont tous deux utilisés pour diagnostiquer la malnutrition aiguë. Une des caractéristiques du système PB est qu’il sélectionne aussi les enfants présentant un retard de croissance. Des recherches récentes ont montré que le risque de décès était très élevé chez les enfants qui étaient en même temps émaciés et atteints de retard de croissance (Myatt et al, 2018) ; il est donc important de concevoir des stratégies qui élargissent les critères d'inclusion pour englober ces enfants afin de réduire la mortalité liée à la malnutrition. Un protocole unique serait probablement le meilleur moyen pour atteindre ces enfants. Deuxièmement, la posologie des ATPE est rationalisée et calibrée en fonction du degré d'émaciation de l'enfant. Les tableaux P/T et les tableaux de dosage sont remplacés par un tableau unique qui détermine la ration d’ATPE de l’enfant en fonction de la catégorie PB et du poids. Les plus grosses rations, calculées au kilo, sont données à ceux souffrant de malnutrition la plus sévère, leur ration étant réduite à mesure que le poids de l'enfant progresse. Troisièmement, la chaîne logistique est simplifiée en un seul ATPE et la gestion des données de deux programmes est fusionnée en un seul. Ce programme simplifié devrait se traduire par une meilleure couverture, une proportion élevée d'enfants dépistés avant que le PB atteigne <115 mm, une consommation d'ATPE par enfant inférieure et un nombre moins élevé d'hospitalisations liées à la malnutrition.
En outre, des données provenant d'essais nutritionnels randomisés récents au Niger (Isanaka et al, 2015) et au Burkina Faso (Cichon et al, 2016) démontrent une morbidité significative chez les enfants avec une PB ≥115 mm. Au Niger, il n’y a pas eu de différence entre la prévalence des complications cliniques chez les enfants avec un PB <115 mm et ceux avec un PB ≥115 et le P/T <-3. Dans l’essai TreatFOOD, chez les enfants atteints de MAM (PB 115-124 mm ou -3 < P/T <-2), 70% des enfants présentaient un état clinique identifié lors de leur admission dans l’étude d’alimentation complémentaire. Cela suggère qu’une grande proportion d’enfants avec un PB entre 115 et 124 mm et souvent classés comme souffrant de MAM pourraient en fait bénéficier de l’évaluation médicale plus approfondie fournie dans les programmes actuels de MAS.
Une étude publiée démontre les espoirs suscités par un protocole simplifié basé sur la mesure du PB. Maust et al (2015) en Sierra Leone ont obtenu > 80 % de guérison chez les enfants traités avec un protocole intégré à régime ATPE réduit basé sur le PB, contre 79 % de guérison avec le protocole de traitement standard. L’étude ComPAS est un essai contrôlé randomisé (RCT en anglais) comparant un tel protocole avec la pratique standard actuelle (Bailey et al, 2018) (résumé dans cette étude de Field Exchange et en attente de publication dans une revue scientifique à comité de lecture en 2019).
OptiMA est l’un des nombreux essais récents visant à simplifier et à rationaliser les protocoles de nutrition, et à combler de manière directe les lacunes de la recherche. Dans Minding the Undernutrition Evidence Gap, les experts ont identifié « la nécessité de simplifier davantage les protocoles » et le traitement de la MAM comme deux priorités (ECF, 2018). The Humanitarian Health Evidence Review par La London School of Hygiene and Tropical Medicine a conclu qu'il fallait donner la priorité à une détection précoce de la MAS (Blanchet et al, 2015). Le Programme de recherche sur la malnutrition aiguë lancé par le Council of Research and Technical Advice (CORTASAM) et réuni dans le cadre de l’Initiative No Wasted Lives a identifié « les critères d’admission et de sortie appropriés pour le traitement de la malnutrition aiguë » et « la recherche de la sécurité, de l’efficacité et de la rentabilité des dosages d’aliments thérapeutiques prêts à l’emploi à doses réduites », parmi les priorités de recherche (No Wasted Lives, 2018).
OptiMA-Burkina Faso
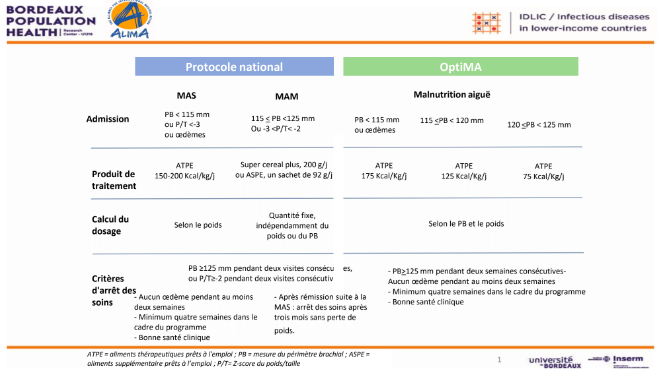
En 2016, ALIMA et ses partenaires burkinabés, Keoogo et SOS Médecins, en partenariat avec le Ministère de la Santé, ont conçu le protocole OptiMA-Burkina Faso sous la forme d'un essai pilote, comparé à un contrôle externe (à savoir, respectant les normes nationales burkinabé et les standards internationaux Sphère). La figure 1 montre les différences entre le protocole actuel du Burkina Faso et OptiMA. La figure 2 présente le tableau des dosages réduits, qui résout le paradoxe posologique actuel selon lequel les enfants reçoivent davantage d'ATPE à la fin du traitement, même après que leur poids s'est stabilisé.
Graphique 1 : Différences entre OptiMA-Burkina Faso et les protocoles actuels du Burkina Faso pour la prise en charge de la malnutrition aiguë.
Graphique 2 : Tableau de dosage des ATPE pour OptiMA-Burkina Faso comparé au dosage du PCIMA actuel du Burkina Faso
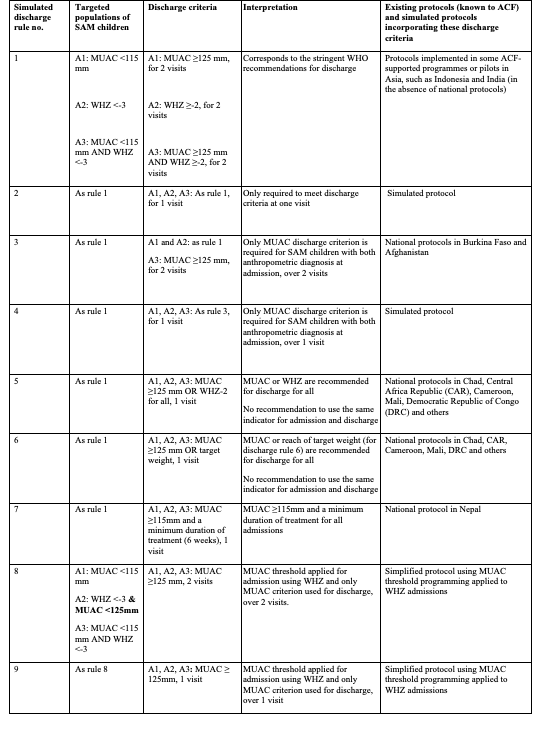
Ceci est uniquement disponible en anglais - désolé pour tout inconvénient causé
L’étude a été menée dans les 54 centres de santé du district de Yako au Burkina Faso, dans la région nord, de janvier 2017 à mars 2018 et a été mise en œuvre par le personnel clinique du Ministère de la Santé. Le personnel de recherche a supervisé et surveillé la collecte de données, à partir desquelles une base de données individuelles a été créée. Une étude distincte a été menée pour déterminer les taux de rechute trois mois après la guérison.
Près de 5000 enfants ont été admis dans le cadre d'OptiMA et seront inclus dans l'analyse. Un petit nombre d'enfants ont présenté un PB ≥125 mm et un P/T <-3 ; ils ont été traités selon le protocole MAS actuel du Burkina Faso. Comme prévu dans une stratégie basée sur la mesure du PB, la prévalence du retard de croissance concomitant était globalement élevée avec 42% des enfants traités sous OptiMA, avec une corrélation positive entre les niveaux de retard de croissance et de l'émaciation : 56% pour ceux ayant un PB <115 mm à l'admission ; 46% pour ceux avec un PB entre 115 et 119 mm ; et 37% pour ceux avec un PB entre 120 et 124 mm.
Discussion et prochaines étapes
Les résultats complets du projet pilote OptiMA-Burkina Faso seront disponibles au cours des prochains mois lorsqu’ils seront publiés dans une revue scientifique soumis à comité de lecture et seront résumés dans Field Exchange. ALIMA espère également partager les enseignements de ce programme dans un prochain numéro de Field Exchange. Malgré les résultats positifs de Maust et al (2015) et les résultats similaires à venir d'OptiMA-Burkina Faso, il est important de comprendre clairement les questions qui doivent encore être abordées. Des RCT sont nécessaires pour déterminer si des petites réductions de dose d’ATPE (par exemple, 150 kcal/kg/j) ont un effet non-inférieur aux schémas posologiques actuels (175-200 kcal/kg/j) chez les enfants présentant un PB <115 mm ou des œdèmes. Deuxièmement, les RCT doivent examiner s’il est « sûr » d’exclure les enfants dont le PB est > 125 mm mais avec un P/T <-2 (enfants actuellement éligibles à PCMA, mais qui ne le seraient pas dans le cadre d’un programme de seuil PB inférieur à 125 mm). Troisièmement, le PB sélectionne systématiquement plus de filles que de garçons, bien qu'il n'y ait aucune raison de penser que les filles d'Afrique subsaharienne sont davantage touchées par la malnutrition aiguë que les garçons ; par conséquent, des RCT sont également nécessaires pour étudier les seuils PB spécifiques au sexe afin de voir si l'équilibre entre les sexes dans la programmation basée sur le PB peut être amélioré. Plus important encore, étant donné que la programmation nutritionnelle est très dépendante du contexte, davantage d'études d'observation sont nécessaires dans plus d'endroits. Cela signifie qu’il est nécessaire d'investir dans la collecte de données de programmes de haute qualité pour permettre la création de bases de données individualisées et contrôlées pour des milliers d'enfants dans plusieurs pays d'Afrique de l’Ouest, de l’Est et du Centre, et dans des zones à forte prévalence de SIDA ou de kwashiorkor.
ALIMA et ses partenaires nationaux ont déjà deux RCT et deux projets pilotes opérationnels en cours dans le cadre de leurs travaux. L'essai OptiMA-RDC, un RCT spécifique qui commencera en 2019, déterminera à quel point cette stratégie fonctionne dans une région enregistrant une forte prévalence d'œdèmes. Le projet OptiMA-Niger, qui sera d’abord un projet pilote opérationnel à petite échelle et deviendra par la suite un essai clinique randomisé de manière individuelle, recueillera des données probantes de la programmation simplifiée dans une région enregistrant une forte prévalence à la fois d'émaciation et de retard de croissance. Et enfin le projet OptiMA-Bamako au Mali, testera l'approche dans une zone urbaine.
Grâce aux résultats du projet OptiMA au Burkina-Faso et à ceux des essais OptiMA à venir, ALIMA espère combler les nombreuses lacunes en matière de recherche dans les années à venir et contribuer à améliorer la prise en charge de la malnutrition aiguë, de manière à ce que davantage d'enfants aient accès a un traitement qui pourrait leur sauver la vie.
Pour en savoir plus, veuillez contacter Kevin Phelan.
Références
ACF et al (2017). Innovations in CMAM Treatment Protocols. A Workshop Report : Dakar, 19 octobre 2017. No Wasted Lives Coalition.
https://static1.squarespace.com/static/58da81cdd1758e39ca705526/t/5b48aa6d352f536d267b8 fab/1531488881208/3+NWL_InnovationsCMAM.pdf
Alé F, Phelan KP, Issa H et al. Mothers screening for malnutrition by mid-upper arm circumference is non-inferior to community health workers: results from a large-scale pragmatic trial in rural Niger. Archives of Public Health. 2016 (74:38).
Bailey J, Lelijveld N, et al. Combined Protocol for Acute Malnutrition Study (ComPAS) in rural South Sudan and urban Kenya: study protocol for a randomized controlled trial. Essais. 24 avril 2018?; 19(1) : 251.
Binns PJ, Dale NM, Banda T, Banda C, Shaba B, Myatt M. Safety and practicability of using mid?upper arm circumference as a discharge criterion in community based management of severe acute malnutrition in children aged 6 to 59 months programmes. Arch Public Health 15 juin 2016 74 : 24. doi : 10,1186/s13690-016-0136-x. eCollection 2016.
Blackwell N, Myatt M, Allafort-Duverger T, Balogoun A, Ibrahim A, Briend A. Mothers Understand And Can do it (MUAC): a comparison of mothers and community health workers determining mid-upper arm circumference in 103 children aged from 6 months to 5 years. Archives of Public Health. 2015 ; 73(1) : 26.
Blanchet K, Sistenich V, et al. An evidence review of research on health interventions in humanitarian crises. London School of Hygiene and Tropical Medicine, October 2015.
Cichon B, et al. Children with moderate acute malnutrition have inflammation not explained by maternal reports of illness and clinical symptoms: a cross-sectional study in Burkina Faso. BMC Nutrition. 2016 ; 2:57
ECF, Minding the Undernutrition Evidence Gap: Findings of the Key Expert Consultation. 2018. Eleanor Crook Foundation, disponible à l'adresse suivante : www.eleanorcrookfoundation.org
Fabiansen C, Yaméogo CW, Iuel-Brockdorf A-S, Cichon B, Rytter MJH, Kurpad A, Shepherd S, et al. (2017) Effectiveness of food supplements in increasing fat-free tissue accretion in children with moderate acute malnutrition: A randomised 2 ? 2 ? 3 factorial trial in Burkina Faso. PLoS Med 14(9): e1002387.
Goossens S, Bekele Y, et al. (2012) Mid-Upper Arm Circumference Based Nutrition Programming: Evidence for a New Approach in Regions with High Burden of Acute Malnutrition. PLoS ONE 7(11): e49320
Isanaka S, et al. Comparison of Clinical Characteristics and Treatment Outcomes of Children Selected for Treatment of Severe Acute Malnutrition Using Mid Upper Arm Circumference and/or Weight-for-Height Z-Score. PLoS One. 2015; 10(9): e0137606.
Maust A, Koroma AS, Abla C, et al. Severe and Moderate Acute Malnutrition Can Be Successfully Managed with an Integrated Protocol in Sierra Leone. J Nutr Nov 2015 ; 145(11) : 2604–9.
Myatt M, Khara T, Schoenbuchner S, et al. Children who are both wasted and stunted are also underweight and have a high risk of death: a descriptive epidemiology of multiple anthropometric deficits using data from 51 countries. Arch Public Health 2018; 76: 28.
Philip T, et al. Low-dose RUTF protocol and improved service delivery lead to good programme outcomes in the treatment of uncomplicated SAM: a programme report from Myanmar. Maternal and Child Nutrition (2015),11, pp. 859–869.
No Wasted Lives, 2018. A statement from the Council of Research & Technical Advice on Acute Malnutrition (CORTASAM). A research agenda for acute malnutrition. No Wasted Lives, 2018.
Shekar M et al. Investing in Nutrition: The Foundation for Development: an Investment Framework to Reach the Global Nutrition Targets. Banque mondiale, 2016.


